
La fécondation in vitro dans l'espèce équine
La fécondation in vitro (FIV) est la mise en contact de gamètes femelles, les ovocytes, et de gamètes mâles, les spermatozoïdes. Cette mise en contact s'effectue dans un milieu artificiel en laboratoire en dehors de l’oviducte de la jument. Depuis 2011, l'équipe de l'INRA de Nouzilly et ses collaborateurs développe une technique de FIV qui permet d’atteindre 64% d’ovocytes fécondés en moyenne, la plupart étant au stade embryon à 1 cellule. L’objectif des travaux actuels est l’amélioration du nombre et de la qualité des embryons obtenus par FIV.
- Principe de la fécondation in vitro
- Intérêts de cette technique
- Historique de la recherche et résultats récents en FIV
Principe de la fécondation in vitro
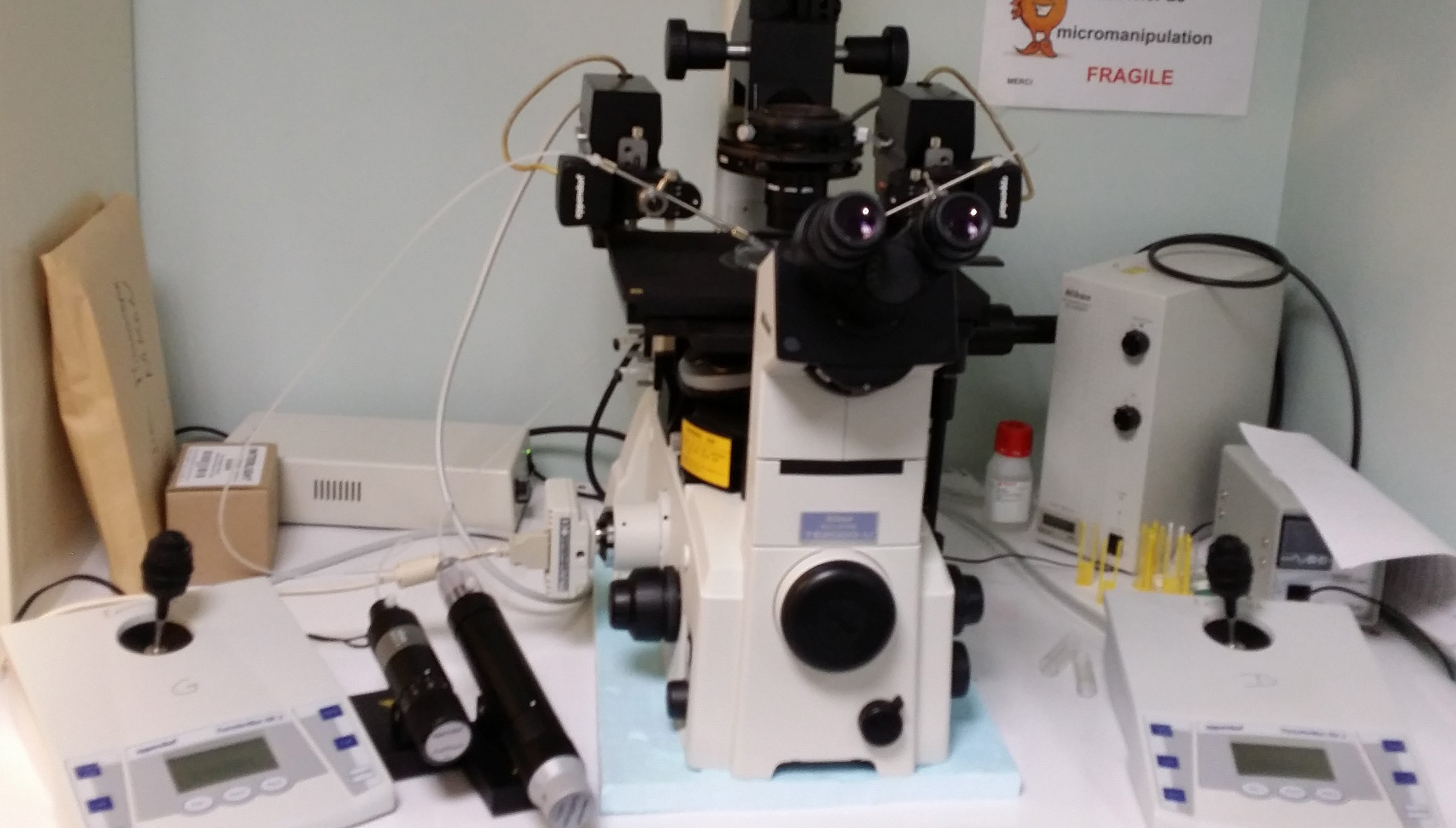
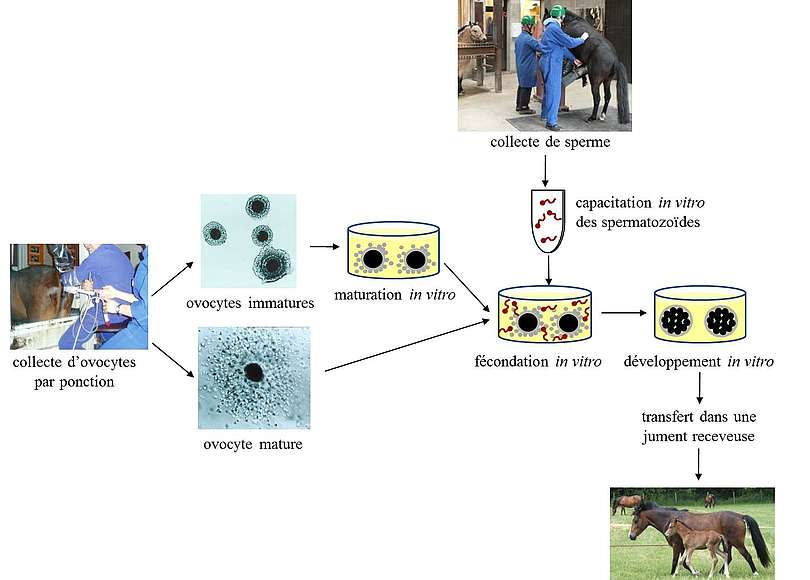
Lors de la fécondation in vitro, les gamètes femelles, les ovocytes et les gamètes mâles, les spermatozoïdes, sont mis en contact dans un milieu favorisant leur interaction (milieu de culture commercial additionné d’hormones, de sérum, de sucres et/ou d’albumine). Puis ce milieu est placé dans un incubateur permettant un environnement adapté à la culture cellulaire : 5% de CO2 dans l’air, 38,5°C, 100% d’humidité (figure 1).
Après quelques heures de co-incubation avec les spermatozoïdes, les ovocytes sont fécondés. Les embryons obtenus peuvent être transférés immédiatement dans l’oviducte d’une jument receveuse par chirurgie ou cultivés in vitro dans un milieu adapté au développement des embryons pendant quelques jours (figure 1) puis transférés dans l’utérus d’une jument receveuse. Après transfert, le développement de l’embryon aura lieu dans la jument receveuse qui assurera la gestation et la mise-bas.
Maturation

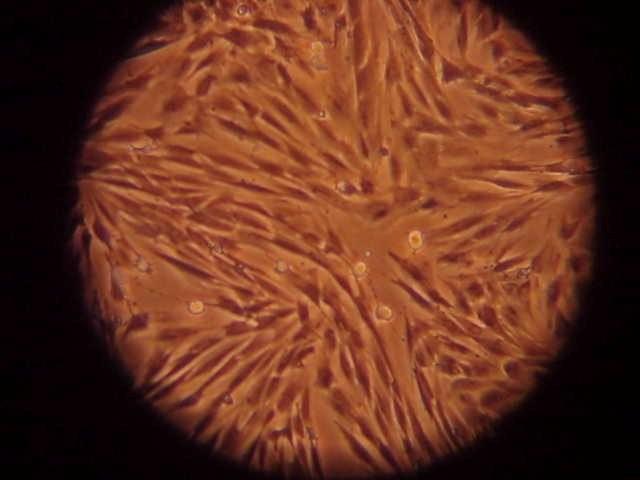
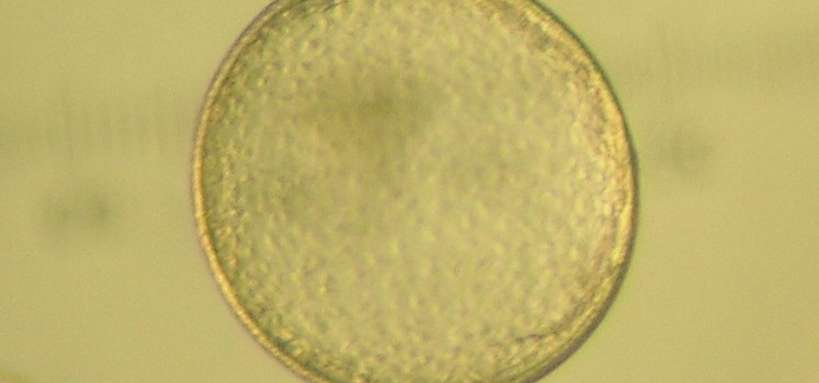
Au cours du cycle, un follicule va poursuivre sa croissance jusqu’au stade préovulatoire puis ovuler. Il contient un ovocyte mature (figure 3 : Ovocyte mature © F. Reigner, G. Duchamp, G. Goudet).
Lors de l’ovulation du follicule préovulatoire, l’ovocyte mature est libéré dans l’oviducte où il pourra être fécondé. Pour réaliser une FIV, il faut donc avoir des ovocytes matures.
Pour cela, deux alternatives sont envisageables :
- Les ovocytes matures peuvent être collectés dans des follicules préovulatoires juste avant l’ovulation, par ponction folliculaire sous contrôle échographique.
- Les ovocytes matures peuvent être obtenus après collecte d’ovocytes immatures dans les petits follicules par ponction folliculaire sous contrôle échographique puis maturation in vitro. La maturation in vitro est réalisée par culture des ovocytes immatures dans un milieu artificiel (milieu de culture commercial additionné d’hormones, de sérum et/ou de facteurs de croissance) dans un incubateur permettant un environnement adapté à la culture cellulaire (5% de CO2 dans l’air, 38,5°C, 100% d’humidité).
Capacitation
Pour féconder un ovocyte, les spermatozoïdes doivent être capacités. En effet, lors d’une saillie ou d’une insémination artificielle, les spermatozoïdes remontent le tractus génital femelle (utérus et oviducte) et subissent de nombreuses modifications qui leur permettent d’acquérir leur pouvoir fécondant. Ces modifications sont appelées capacitation. Pour réaliser une fécondation in vitro, il faut donc avoir des spermatozoïdes capacités. Le sperme collecté sur un étalon à l’aide d’un vagin artificiel n’est pas capacité, il doit donc subir un traitement de capacitation in vitro. Pour cela, il est mis en contact avec des milieux contenant des agents capacitants ou des agents induisant des modifications similaires à la capacitation (héparine, ionophore calcique, ions bicarbonates, albumine, procaïne).
Intérêts de cette technique
La technique de fécondation in vitro permet la production d’embryons in vitro et présente deux avantages principaux.
- D’abord, les embryons étant cultivés in vitro, ils peuvent être sortis de leur boite de culture et utilisés à n’importe quel stade de développement. Il est donc possible d’utiliser de jeunes embryons de petit diamètre, qui ont un meilleur taux de survie après congélation par les techniques classiques que les embryons collectés in vivo dans l’utérus à partir de 6,5 jours post-ovulation.
- Ensuite, la production d’embryons in vitro permet de produire plusieurs embryons par cycle en collectant plusieurs ovocytes immatures par ponction folliculaire. Les ovocytes sont soumis à une maturation et fécondation in vitro, puis les embryons produits sont cultivés in vitro, congelés et/ou transférés dans une femelle receveuse.
En raison de ces avantages, la technique de FIV offre plusieurs applications pratiques décrits ci-après.
Faire reproduire des animaux de haute valeur génétique ayant une mauvaise fertilité
Lorsque les reproducteurs ont une grande valeur génétique mais sont peu ou pas fertiles, la production d’un embryon nécessite des techniques de procréation assistée, et notamment la fécondation in vitro.
Pour des juments présentant des problèmes d’ovulation (lutéinisation du follicule préovulatoire avant l’ovulation par exemple), des problèmes au niveau de l’oviducte (remontée des spermatozoïdes, transport de l’ovocyte ou de l’embryon altérés) ou de l’utérus (transport, survie ou implantation de l’embryon altérés), il est possible de collecter des ovocytes dans l’ovaire et de réaliser une FIV.
Pour des étalons ayant un sperme peu concentré, riche en spermatozoïdes anormaux, ou des spermatozoïdes ayant une faible mobilité qui altère leur remontée dans le tractus femelle, il est possible de collecter le sperme, de le concentrer et de réaliser une FIV.
Les embryons obtenus peuvent ensuite être transférés dans une jument receveuse par transfert d'embryon.
Mieux gérer la carrière sportive des reproducteurs
La gestion raisonnée de la carrière sportive du cheval laisse parfois peu ou pas de temps pour la reproduction. Une jument qui pourrait produire sur un cycle de reproduction plusieurs embryons transférés dans des juments receveuses ou congelés dans l’attente d’un transfert, serait ensuite disponible pour une carrière sportive.
La production de plusieurs embryons sur un cycle n’est pas envisageable par l’administration d’un traitement de superovulation, car les techniques de superovulation disponibles en élevage sont peu efficaces et le nombre d’embryons collectés reste limité. De plus, il n’est pas possible de collecter des jeunes embryons, puisque les embryons équins ne descendent dans l’utérus que vers 6,5 jours, et la plupart de ces embryons ont atteint un stade où leur taux de survie après congélation classique est faible. Par contre, la production de plusieurs jeunes embryons sur un cycle est envisageable par collecte de plusieurs ovocytes immatures par ponction folliculaire, maturation in vitro, fécondation in vitro et culture in vitro des embryons.
Sauvegarder des espèces menacées et maintenir la biodiversité
La plupart des équidés sauvages sont actuellement menacés de disparition. C'est le cas par exemple du zèbre de Grevy ou de l’âne sauvage d’Asie. De plus, plusieurs races d’équidés domestiques sont en voie d’extinction, avec moins de 100 femelles en activité en 2013. C’est le cas par exemple pour le poney Landais, l’âne Bourbonnais, l’âne de Provence, le Grand Noir du Berry, l’âne Normand, etc.
La fécondation in vitro est un outil pour la préservation de la biodiversité des équidés, via d’une part la préservation du patrimoine génétique existant et d’autre part la sauvegarde des races en voie d’extinction. La préservation du patrimoine génétique existant nécessite la préservation de la lignée mâle par congélation du sperme et la préservation de la lignée femelle par congélation des ovocytes et/ou des embryons. Dans l’espèce équine, la préservation de la lignée femelle n’est pas encore totalement maîtrisée. Dans l’espèce asine, ni la préservation de la lignée mâle, ni celle de la lignée femelle ne sont maîtrisées.
La production d’embryons in vitro permet d’obtenir de jeunes embryons qui ont un meilleur taux de survie après congélation par les techniques classiques que les embryons de grande taille collectés in vivo dans l’utérus à partir de 6,5 jours post-ovulation. D’autre part, la sauvegarde des races en cours d’extinction nécessite la production de nombreux embryons à partir des animaux restants. Si le nombre de femelles est limité, il est alors urgent de produire un grand nombre d’embryons dans un temps court. Les traitements de superovulation étant peu efficaces, la production de plusieurs embryons sur un cycle est envisageable par collecte de plusieurs ovocytes immatures par ponction folliculaire, maturation puis fécondation in vitro et culture in vitro des embryons. Les embryons peuvent ensuite être transférés dans une femelle receveuse d’une race proche ou congelés dans l’attente d’un transfert.
Tester la qualité des gamètes
De plus, la FIV est un excellent outil pour tester la qualité des gamètes. En effet, la qualité du sperme d’un étalon est estimée actuellement par des mesures de concentration, de mobilité et de pourcentage de spermatozoïdes anormaux. Cependant, les tests actuellement disponibles sont peu corrélés à la fertilité de l’étalon. Le meilleur critère de qualité du sperme est l’aptitude des spermatozoïdes à féconder un ovocyte. La FIV permet de mesurer le pourcentage d’ovocytes fécondés pour un éjaculat donné, soit en sperme frais, soit après congélation du sperme. C’est un critère supplémentaire pour l’évaluation du sperme d’un étalon ou l’évaluation d’une technique de conservation du sperme. La fécondation in vitro peut aussi permettre de tester la qualité des ovocytes d’une jument infertile malgré des ovulations normales.
Produire des embryons pour la recherche appliquée
La FIV permet de fournir les embryons nécessaires pour la recherche appliquée. En effet, les pertes embryonnaires précoces sont une cause importante d’infertilité. Elles sont dues en partie à des anomalies de fécondation et/ou de développement précoce au niveau de l’oviducte. Ces étapes étant peu accessibles in vivo, la production d’embryons par FIV permet d’étudier in vitro la fécondation et le développement embryonnaire pour identifier les périodes critiques et les causes d’arrêt du développement. De plus, la mise au point des techniques de congélation/vitrification des embryons équins est limitée par le faible nombre d’embryons disponibles pour les études. La fécondation in vitro permet d’augmenter le nombre d’embryons pour les expérimentations et d’accélérer l’avancée de la recherche. La FIV est donc un outil indispensable pour la recherche appliquée concernant la fertilité, la qualité des gamètes, le développement précoce et la conservation de l’embryon.
Historique de la recherche et résultats récents en FIV
A partir de 1989
Dans l’espèce équine, les premiers travaux publiés concernant la FIV datent de 1989, au Colorado, dans l’équipe d’A. McKinnon et E. Squires. La première gestation après fécondation in vitro a été obtenue en 1990 en France dans le laboratoire d’E. Palmer, M. Magistrini, J. Bézard et G. Duchamp. Le premier poulain est né en 1991. Il a été obtenu à partir d’ovocytes matures et de sperme frais traité à l’ionophore calcique. Cette technique de FIV a permis d’obtenir 30% d’ovocytes fécondés.
En 1996
L’équipe italienne de M.E. Dell’Aquila et G. Lacalandra a développé une technique de FIV à partir d’ovocytes immatures et de sperme congelé traité à l’héparine. Elle a permis d’atteindre 32% d’ovocytes fécondés.
En 2009,
L’équipe américaine de L. McPartlin et S. Bedford-Guaus a publié une technique de FIV à partir d’ovocytes immatures et de sperme frais traité à la procaïne. Elle a permis d’atteindre 61% d’ovocytes fécondés. La même année, notre équipe (S. Mugnier, C. Douet, G. Duchamp, G. Goudet) a montré que la présence de cellules ou de sécrétions d’oviducte lors de la FIV améliorait les taux de fécondation in vitro.
Depuis 2011
L'équipe de l'INRA de Nouzilly développe une technique de FIV qui permet d’atteindre 64% d’ovocytes fécondés en moyenne. Les ovocytes immatures collectés sont soumis à une maturation in vitro puis une incubation en présence de fluide d’oviducte. Du sperme frais collecté qui est traité à la procaïne. Après FIV, 64% d’ovocytes fécondés sont obtenus en moyenne. Après 48 heures de culture, la plupart des embryons sont au stade 1 cellule contenant 2 pronoyaux (figure 5) : un pronoyau femelle contenant l'ADN de l’ovocyte et un pronoyau mâle contenant l'ADN du spermatozoïde.
Quelques embryons se sont clivés et sont au stade d’embryons à 2 ou 4 cellules. Cependant, ils ne poursuivent pas leur développement lors d'une culture in vitro plus longue. La qualité de ces embryons doit être améliorée afin d’obtenir des gestations après transfert dans une femelle receveuse. L’objectif des travaux actuels est l’amélioration du nombre et de la qualité des embryons obtenus par FIV.
Sur les photos ci-dessus, on observe un embryon au stade 1 cellule avec marquage du pronoyau femelle issu de l'ovocyte et du pronoyau mâle issu du spermatozoïde (coloration de l'ADN en bleu de Hoechst) et marquage des membranes des pronoyaux (coloration avec un anticorps couplé à un fluorochrome rouge).

En savoir plus sur nos auteurs
- Ghylène GOUDET
- Cécile DOUET
- Sylvie MUGNIER
- Barbara AMBRUOSI
- Guy DUCHAMP
- Stéphan DELEUZE
- Fabrice REIGNER
Bibliographie
- AMBRUOSI B., ACCOGLI G., DOUET C., CANEPA S., PASCAL G., MONGET P., MOROS NICOLAS C., HOLMSKOV U., MOLLENHAUER J., ROBBE-MASSELOT C., VIDAL O., DESANTIS S., GOUDET G., 2013. Deleted in Malignant Brain Tumor 1 (DMBT1) is secreted in the oviduct and involved in the mechanism of fertilization in equine and porcine species. Reproduction, 146 (2), 119-133.
- GOUDET G., 2011. Fertilisation in the horse and paracrine signalling in the oviduct. Reproduction, Fertility and Development 23, 941-951.
- DELEUZE S., DUBOIS C.S., CAILLAUD M., BRUNEAU B., GOUDET G., DUCHAMP G., 2010. Influence of cysteamine on in vitro maturation, in vitro and in vivo fertilization of equine oocytes. Reproduction in Domestic Animals 45 (1), 1-7.
- MUGNIER S., KERVELLA M., DOUET C., CANEPA S., PASCAL G., DELEUZE S., DUCHAMP G., MONGET P., GOUDET G., 2009. The secretions of oviduct epithelial cells increase the equine in vitro fertilization rate: are osteopontin, atrial natriuretic peptide A and oviductin involved? Reproductive Biology and Endocrinology 7, 129.